Szybki cykl węglowy to procesy wymiany węgla pomiędzy atmosferą, ekosystemami lądowymi i oceanami, zachodzące w krótkiej (nie geologicznej) skali czasowej. O roślinności i glebach pisaliśmy w pierwszej części naszego artykułu. Tym razem zapraszamy na wyprawę w morskie głębiny.

Węgiel w oceanie
Oceany zawierają blisko 40 000 GtC – wielokrotnie więcej niż ekosystemy lądowe i atmosfera. Zdecydowana większość węgla w oceanie występuje w formie utlenionej, nieorganicznej. Ponad 90% węgla nieorganicznego rozpuszczonego w wodach oceanów ma postać jonów wodorowęglanowych HCO3–, reszta to w większości jony węglanowe CO32-, występują też cząsteczki rozpuszczonego dwutlenku węgla CO2. Ponadto w wodzie znajduje się także ok. 700 GtC rozpuszczonego węgla organicznego a w planktonie, rybach i innych organizmach żywych – ok. 3 GtC.
Powierzchniowe wody oceanów do głębokości ok. 100 m są mieszane przez wiatr i ciśnienie CO2 w tych wodach dąży do równowagi z tym w atmosferze:
CO2(atm) ⇌ CO2(aq)
Pisząc o ciśnieniu danego gazu i równowadze ciśnień, mamy na myśli tzw. ciśnienie cząstkowe (zwane też parcjalnym), czyli ciśnienie, jakie wywiera dany składnik mieszaniny gazów (tu: CO2), gdyby w tej samej temperaturze sam zajmował objętość całej mieszaniny.
W osiągnięciu tego stanu przeszkadzają różne procesy biologiczne, chemiczne i fizyczne, w praktyce więc taka idealna równowaga nie występuje. Koncentracje CO2 (a precyzyjniej mówiąc, ciśnienia cząstkowe) w atmosferze i powierzchniowych wodach oceanów są jednak ze sobą bezpośrednio powiązane.
Aby zrozumieć zachowanie się węgla w oceanie, trzeba zauważyć, że CO2 różni się od innych gazów tym, że nie rozpuszcza się po prostu w wodzie, ale trafiając do oceanu, uczestniczy w serii reakcji.

Co się dzieje z CO2 trafiającym do oceanu?
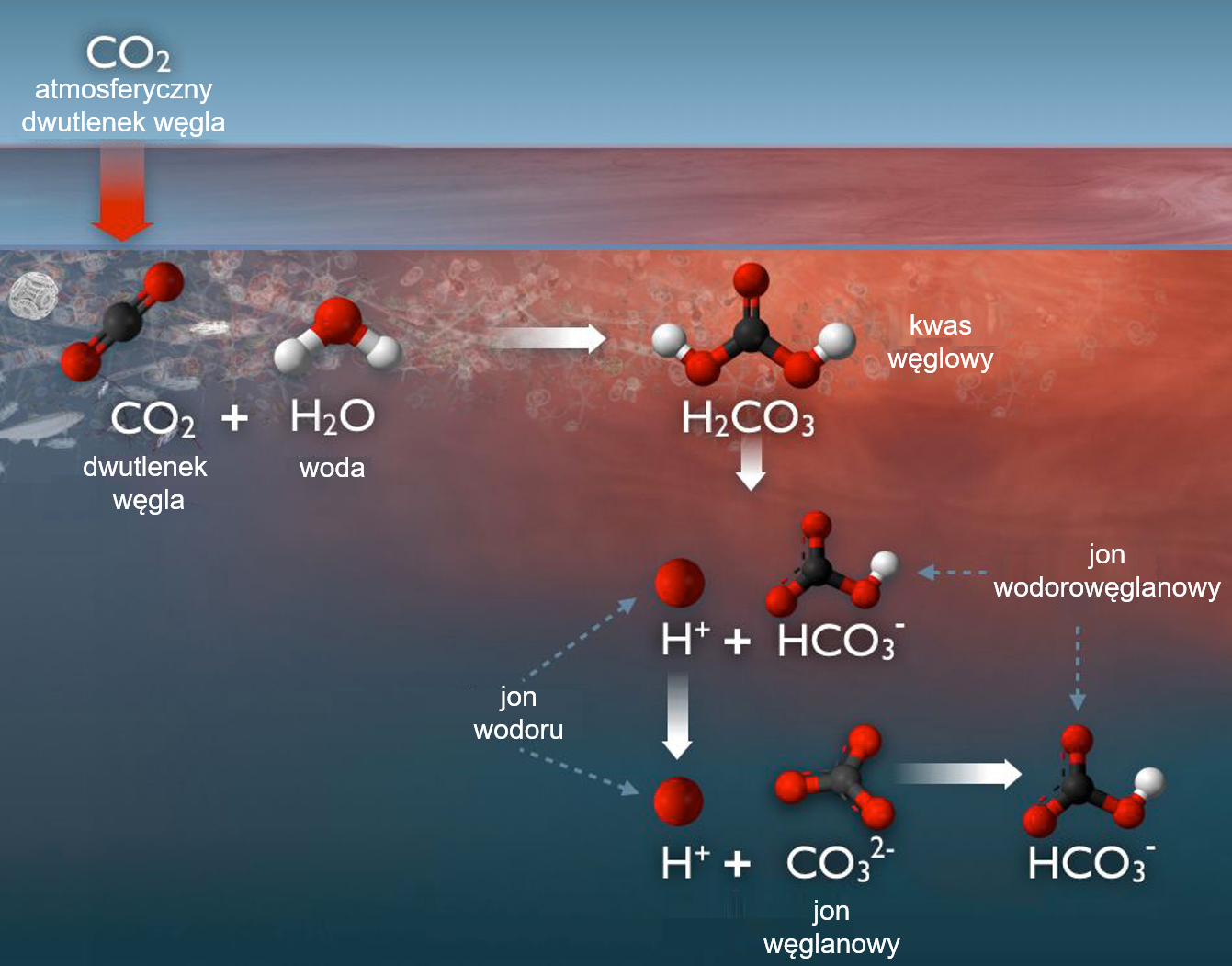
Rozpuszczony w wodzie dwutlenek węgla najpierw reaguje z nią, tworząc bardzo nietrwałą cząsteczkę kwasu węglowego H2CO3, który praktycznie natychmiast dysocjuje (rozpada się) na jony wodorowy i wodorowęglanowy:
| CO2(aq) + H2O ⇌ H+ + HCO3– | (1) |
Jeśli zostanie uwolniony drugi jon wodorowy, może utworzyć się jon węglanowy CO32- :
| HCO3– ⇌ H+ + CO32- | (2) |
Zachodzące reakcje zapisaliśmy ze strzałkami dwukierunkowymi, ponieważ każda z tych reakcji może zachodzić w obie strony. Nie oznacza to bynajmniej, że w stanie równowagi po lewej i prawej stronie będziemy mieć takie same ilości cząsteczek. Wyobraź sobie stół, przy którym siedzi 6 osób: 5 osób po jednej stronie, a 1 osoba po drugiej. Każdy dostaje torbę orzeszków i zaczyna przerzucać je po jednym na drugą stronę. Z początku liczba orzeszków lecących ze strony, gdzie jest 5 osób, będzie pięciokrotnie większa, jednak po pewnym czasie prawie wszystkie znajdą się po stronie, gdzie jest 1 osoba. Teraz grupa pięcioosobowa będzie odrzucać orzeszki w takim tempie, w jakim będą one nadlatywać od pojedynczej osoby naprzeciwko. Osiągnięty został stan równowagi. Liczba orzeszków po każdej stronie pozostaje niezmienna, choć pojedyncze orzeszki mogą zmieniać strony.
Podobnie (choć większość reakcji chemicznych może zachodzić w obie strony), w określonych warunkach (zależnych np. od takich zmiennych jak temperatura, ciśnienie, współczynnik pH czy obecność innych cząsteczek) faworyzowany jest zwykle jeden z kierunków. W notacji chemicznej zwykło się zapisywać uprzywilejowany kierunek reakcji (często o czynnik tysięcy, milionów lub nawet większy) jednokierunkową strzałką prowadzącą w prawo od substratów do produktów. Reakcje chemiczne przebiegają aż do osiągnięcia stanu równowagi, w którym proporcje cząstek po lewej i prawej stronie reakcji stabilizują się na określonym poziomie, co oznacza, że tyle samo reakcji zachodzi „w lewą” i „w prawą” stronę równania. Liczba molekuł po obu stronach równania będzie przy tym zazwyczaj bardzo różna.

W wodach oceanów mamy do czynienia z roztworem, w którym w pewnych proporcjach znajdują się CO2, HCO3– i CO32-. Proporcje i równowaga między tymi związkami chemicznymi zależą od panujących w danym miejscu warunków, np. temperatury, ciśnienia i koncentracji jonów. Zanim jednak przyjrzymy się tej zależności bliżej, zapiszmy jeszcze jedną reakcję:
CO2 + CO32- + H2O ⇌ 2HCO3–
Faworyzowany jest w niej kierunek od lewej do prawej – w typowych panujących w oceanie warunkach zachodzący mniej więcej w proporcji 1000:1, możemy więc z dobrym przybliżeniem zapisać, że jest to reakcja jednokierunkowa:
CO2 + CO32- + H2O → 2HCO3–
W oceanie będziemy mieć więc bardzo dużo HCO3– i stosunkowo niewiele CO2 i CO32-.
Skład wody w oceanie a współczynnik pH
Skupmy się na zależności koncentracji interesujących nas jonów od współczynnika pH, który jest funkcją koncentracji jonów H+ w roztworze. W bardziej poprawnej, współczesnej nomenklaturze, mówimy o jonach hydroniowych H3O+, bo swobodne jony H+ w roztworach wodnych nie występują, zawsze reagując do H3O+. Definicja współczynnika jest następująca:
pH = -log10 [H3O+]
gdzie H3O+ oznacza stężenie jonów hydroniowych wyrażone w molach na litr roztworu. Im wyższe ich stężenie w roztworze, tym jego pH niższe, czyli kwasowość wyższa. Warto zauważyć, że skala kwasowości jest skalą logarytmiczną – zmiana współczynnika pH o 1 odpowiada więc aż 10-krotnej zmianie ilości jonów wodorowych. Roztwór o odczynie pH = 7 jest nazywany neutralnym, pH mniejsze od 7 oznacza roztwór o odczynie kwasowym, a większe od 7 o odczynie zasadowym.
Odczyn pH = 7 odpowiada odczynowi czystej wody. Skąd biorą się w niej jony H3O+? Z reakcji dysocjacji (czyli rozpadu cząsteczki na jony pod wpływem rozpuszczalnika) wody 2H2O ⇌ OH– + H3O+, która w czystej wodzie zachodzi z małą, lecz niezerową intensywnością. Czysta woda deszczowa, nawet pozbawiona jakichkolwiek zanieczyszczeń i domieszek, ma pH = 5,7, jest więc lekko kwasowa. Dlaczego? Jest tak, ponieważ znajduje się w równowadze z obecnym w atmosferze dwutlenkiem węgla, który ją zakwasza. Pomimo kwaśnego odczynu wciąż jest to jednak czysta deszczówka; „kwaśnym deszczem” nazywamy wodę deszczową zanieczyszczoną dodatkowo siarczanami lub azotanami, które tworzą cząsteczki kwasu siarkowego lub azotowego, obniżające pH jeszcze bardziej.
Rysunek 4 pokazuje zależność koncentracji molekuł CO2, jonów wodorowęglanowych HCO3– i jonów węglanowych CO32- od współczynnika pH wody morskiej (przy uśrednionej temperaturze i zasoleniu).
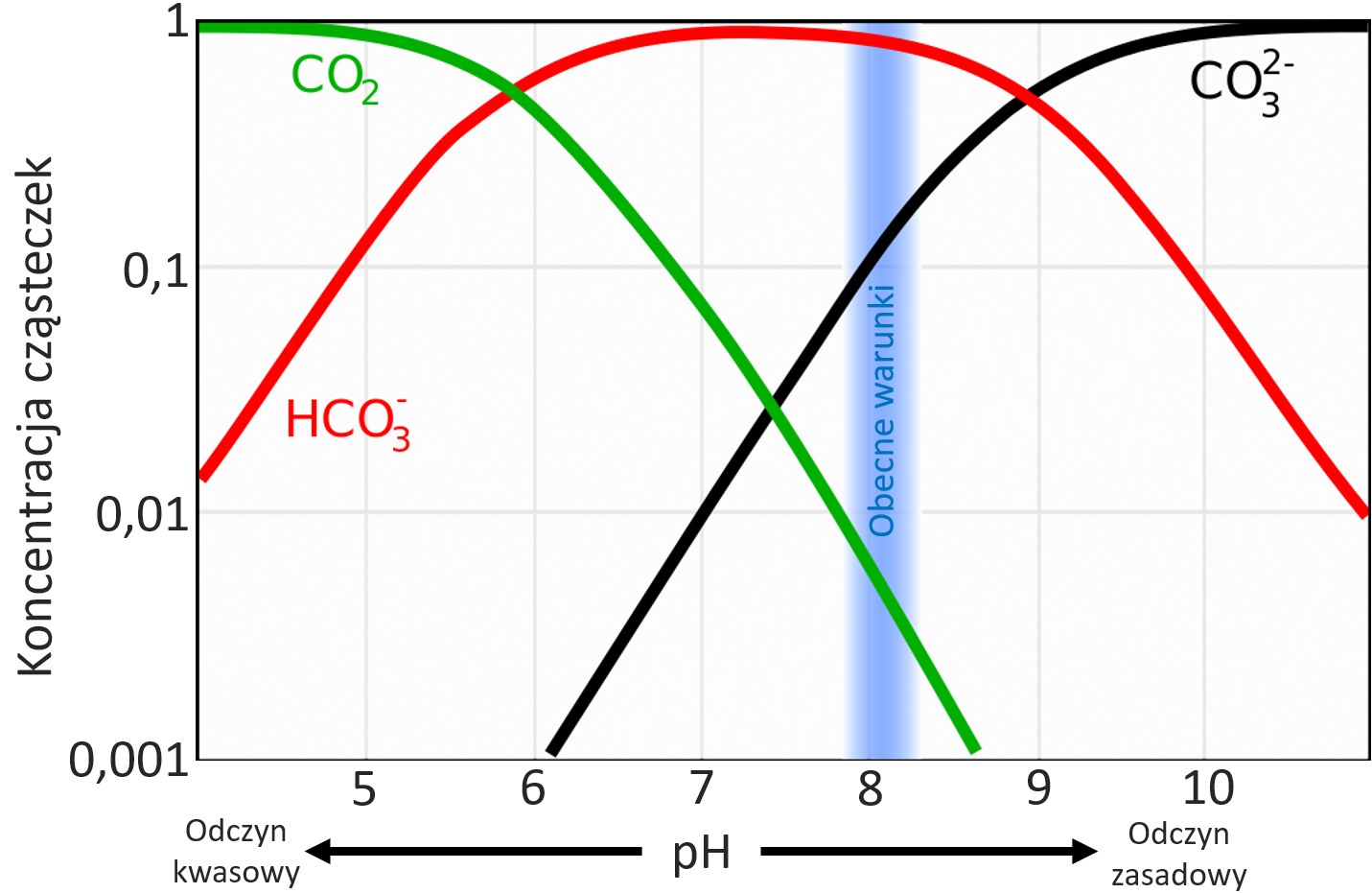
W warunkach obecnie panujących w oceanach blisko 90% cząsteczek zawierających węgiel stanowią jony HCO3–, jony węglanowe ok. 10%, a dwutlenek węgla niecały 1%.
Co się dzieje, gdy w atmosferze przybywa CO2?
Przyjrzyjmy się sytuacji, w której zostaje zaburzona równowaga chemiczna stężeń CO2 między atmosferą i wodami oceanów, na przykład przez wzrost atmosferycznej koncentracji tego gazu. Powiedzmy, że dla przywrócenia stanu równowagi chemicznej oceany powinny pochłonąć pewną liczbę n cząsteczek CO2. Ocean absorbuje je więc. Ale to wcale nie koniec…
Ponieważ chętnie zachodzi reakcja CO2 + CO32-+ H2O → 2HCO3– , a liczba molekuł CO32- w wodzie morskiej jest mniej więcej 10-krotnie większa od liczby molekuł CO2, dodawany do wody morskiej dwutlenek węgla będzie reagował z (względnie) obficie dostępnym CO32-, tworząc cząsteczki . W ten sposób część molekuł CO2 jest „ukrywana” w oceanie – jony takie jak HCO3– nie mogą bowiem opuścić wody i przejść do powietrza, a jednocześnie, z punktu widzenia równowagi chemicznej, w wodzie pojawia się miejsce na jeszcze trochę dwutlenku węgla.
Równocześnie ze „zniknięciem” n cząsteczek CO2 „znikło” (czyli zamieniło się w HCO3–) n jonów CO32-. Tych drugich jest w wodzie morskiej mniej więcej 10 razy więcej niż cząsteczek CO2, a pochłanianie CO2 przez ocean zachodzi przez usuwanie CO32-. To oznacza, że oceany są w stanie pochłonąć 10-krotnie więcej CO2. W naszym przykładzie oznacza to, że dla przywrócenia równowagi ciśnień cząstkowych CO2 między atmosferą i wodą oceanów, ocean pochłonie nie n, ale 10n cząsteczek CO2.
Inaczej mówiąc, występujący relatywnie obficie w wodzie morskiej CO32- działa jak bufor absorbujący jony wodorowe i pozwalający na pochłanianie dużych ilości CO2 bez znaczącej zmiany współczynnika pH roztworu.
Zakwaszanie oceanu – konsekwencje
W rezultacie wchłonięcia dodatkowej porcji CO2 przez wody oceaniczne, spada w nich nie tylko współczynnik pH, ale też ilość dostępnych jonów węglanowych. Występują tu one przede wszystkim w formie węglanu wapnia CaCO3, który jest podstawowym materiałem dla zwierząt morskich budujących swoje szkieleciki. Czasem wykorzystywane są też inne minerały, na przykład promienice i okrzemki, podobnie jak większość gąbek, budują szkieleciki z krzemu; kręgowce zaś preferują fosforany. Jednak węglan wapnia jest używany najpowszechniej. Dlaczego? Najkrócej mówiąc, dlatego że jest wytrzymały, (zazwyczaj) nierozpuszczalny i łatwo dostępny. No i oczywiście dlatego, że w warunkach panujących w powierzchniowej wodzie morskiej reakcja tworzenia węglanu wapnia jest energetycznie korzystna i przebiega spontanicznie, co pozwala morskim organizmom budować wapienne szkieleciki bez specjalnego wysiłku.
Reakcja wykorzystywana przez zwierzęta do budowy szkielecików z węglanu wapnia wygląda następująco (ze względu na dużo wyższe prawdopodobieństwo reakcji „w prawo” w równaniu zapisaliśmy strzałkę jednokierunkową):
| Ca2+ + 2HCO3– → CaCO3 + CO2 + H2O | (3) |
Warto zauważyć, że procesy chemiczne, w których powstają muszle i rafy koralowe, są źródłem emisji CO2. Budulcem w procesie tworzenia szkielecików z węglanu wapnia jest jon wodorowęglanowy. Wydawałoby się więc, że gdy oceany zakwaszają się w wyniku pochłaniania dodatkowych ilości CO2, w wyniku czego rośnie ilość jonów wodorowęglanowych, organizmy będą miały coraz więcej budulca do swoich skorupek i będzie im coraz łatwiej je budować. Jednak okazuje się, że jest to dla nich proces bardzo niekorzystny. Dlaczego?

Węglan wapnia CaCO3 jest solą, czyli substancją zawierającą jon o dodatnim ładunku elektrycznym (kation, jak wapń Ca2+ lub sód Na+) oraz jon o ujemnym ładunku elektrycznym (anion, jak węglan CO32- lub chlor Cl–). Dobrze znana sól kuchenna, czyli chlorek sodu NaCl, jest utworzona z jonów Na+ i Cl–. Gdy sól jest rozpuszczona w wodzie, nie znajduje się w niej w postaci cząsteczek, lecz odizolowanych od siebie jonów otoczonych przez cząsteczki wody. W roztworze może być rozpuszczona określona ilość substancji, powyżej której zacznie się ona wytrącać z roztworu. Jeśli mamy na przykład do czynienia z roztworem NaCl w wodzie, to w miarę jak woda paruje, zaczyna brakować molekuł H2O, by skutecznie oddzielać od siebie jony soli, te zaś zaczynają się przyciągać, a w rezultacie powstają kryształy NaCl.
Jak zakwaszanie oceanu szkodzi organizmom żywym?
Dopóki ilość soli w roztworze jest mniejsza od progu rozpuszczalności, kolejne dodawane do roztworu porcje soli będą się w nim rozpuszczać – mówimy wtedy o roztworze nienasyconym. Roztwór, w którym w danych warunkach (np. temperaturze) jest rozpuszczona maksymalna ilość danej soli, nazywamy roztworem nasyconym. W takim roztworze dodatkowa ilość soli będzie wytrącać się w formie stałej. Roztwory mogą być też przesycone, czyli mogą zawierać więcej jonów, które mogą wytrącić się do soli, niż w roztworze nasyconym. To, jak bardzo roztwór jest przesycony w stosunku do roztworu nasyconego, nazywamy stopniem nasycenia roztworu Ω. Dla roztworu nasyconego Ω = 1 sól ani się nie wytrąca, ani nie dysocjuje. Budowa muszli zachodzi zwykle wtedy, gdy roztwór jest przesycony (Ω > 1), a rozpuszczanie, gdy roztwór jest nienasycony (Ω spada poniżej 1).

Rozpuszczalność różnych substancji w wodzie słodkiej i słonej bywa bardzo zróżnicowana. Przykładowo dla chlorku sodu w wodzie słodkiej w temperaturze pokojowej wynosi aż 360 gramów na kilogram wody, podczas gdy dla fluorku sodu już tylko 41 gramów. Węglan wapnia ma w wodzie słodkiej jeszcze mniejszą rozpuszczalność – w tych samych warunkach tylko 0,01 g. Tymczasem w wodzie morskiej jego rozpuszczalność jest około 10 razy większa (nie wchodząc w szczegóły – wynika to głównie z obecności w niej dodatkowych jonów Ca2+ w ilości ponad 400 mg/kg).
Węglan wapnia może występować w różnych odmianach różniących się ułożeniem atomów w sieci krystalicznej i mających w związku z tym różne własności, w szczególności – rozpuszczalność. Życie morskie preferuje kalcyt i aragonit. Ten drugi ma większą rozpuszczalność, a wykorzystują go m.in. koralowce czy kryl. Z kalcytu korzystają np. kokolitofory i otwornice, małże potrafią używać obu form węglanu wapnia.
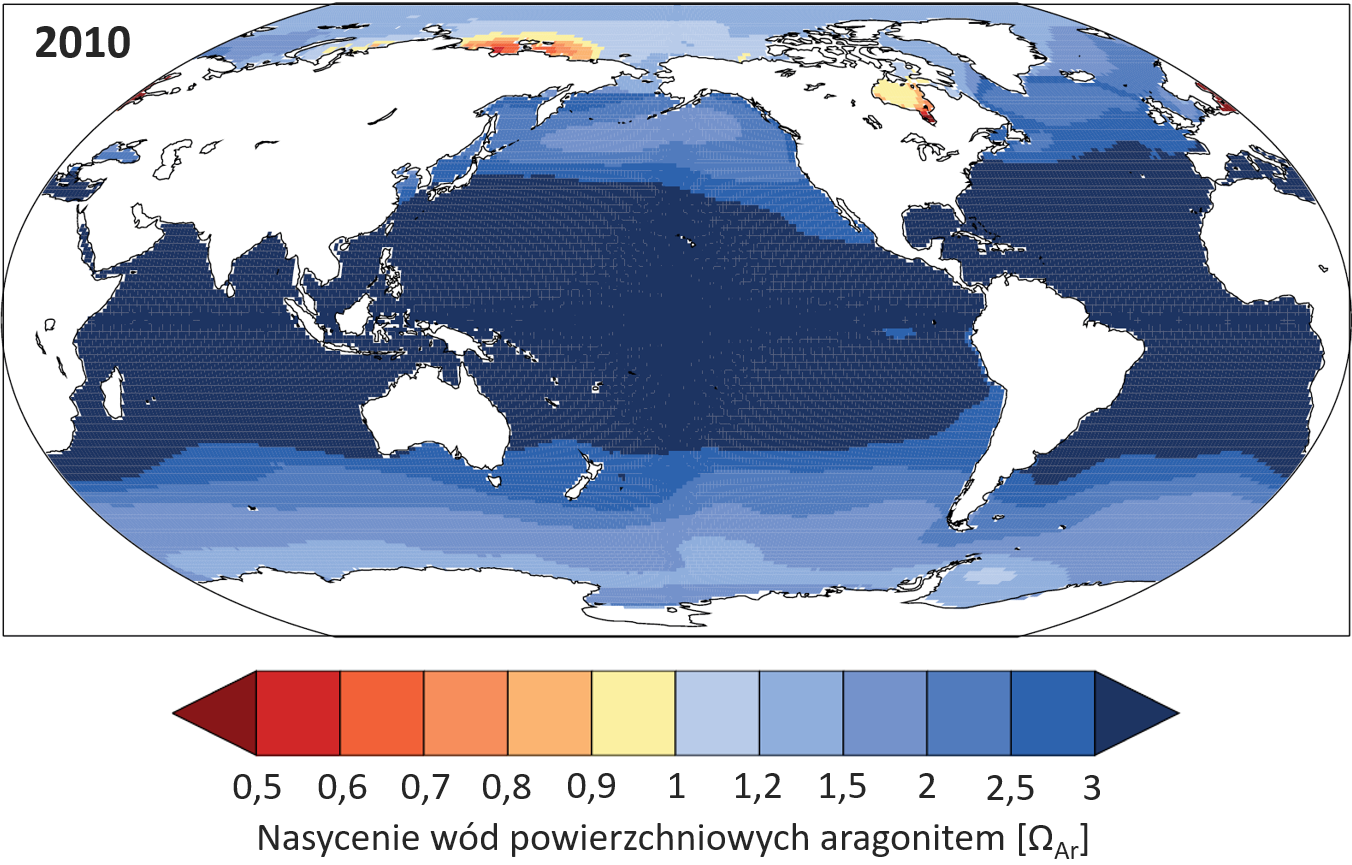
Źródło Clais i in., 2013, IPCC AR5, WG1.
W przypadku CaCO3 typową sytuacją jest przesycenie nim wód oceanów. Wynika to z faktu, że koncentracja jonów HCO3– jest wielokrotnie większa od koncentracji CO32-, co dzięki „dwukierunkowości” reakcji chemicznych (1) i (2) prowadzi do stałego wytwarzania (i znikania) jonów węglanowych, które z kolei łatwo mogą wejść w reakcję z obficie dostępnymi jonami Ca2+. Dzięki temu, że roztwór CaCO3 w powierzchniowych wodach oceanów jest silnie przesycony, węglan wapnia bardzo łatwo się wytrąca i łatwe jest również wykorzystanie go do budowy muszli.
Widać już, dlaczego zakwaszanie oceanów jest problemem: oznacza ono spadek nasycenia wody jonami węglanowymi, przez co roztwór staje się coraz mniej nasycony, a może wręcz stawać się nienasyconym. To z kolei powoduje, że zbudowane z węglanu wapnia muszle zamiast narastać, będą się rozpuszczać. Więcej o problemach, jakie zakwaszanie oceanu przynosi morskim zwierzętom przeczytasz w tekstach Mit: Zakwaszanie oceanu nie szkodzi morskim stworzeniom, Mit: Wzrost emisji CO2 nie ma wpływu na oceany.
Jak CO2 krąży między atmosferą i różnymi częściami oceanu?
Wspomnieliśmy, że powierzchniowe wody oceanów dążą do osiągnięcia równowagi ciśnień cząstkowych CO2 z atmosferą, jednak różne procesy biologiczne, chemiczne i fizyczne przeszkadzają w jej osiągnięciu. Przyjrzyjmy się temu.
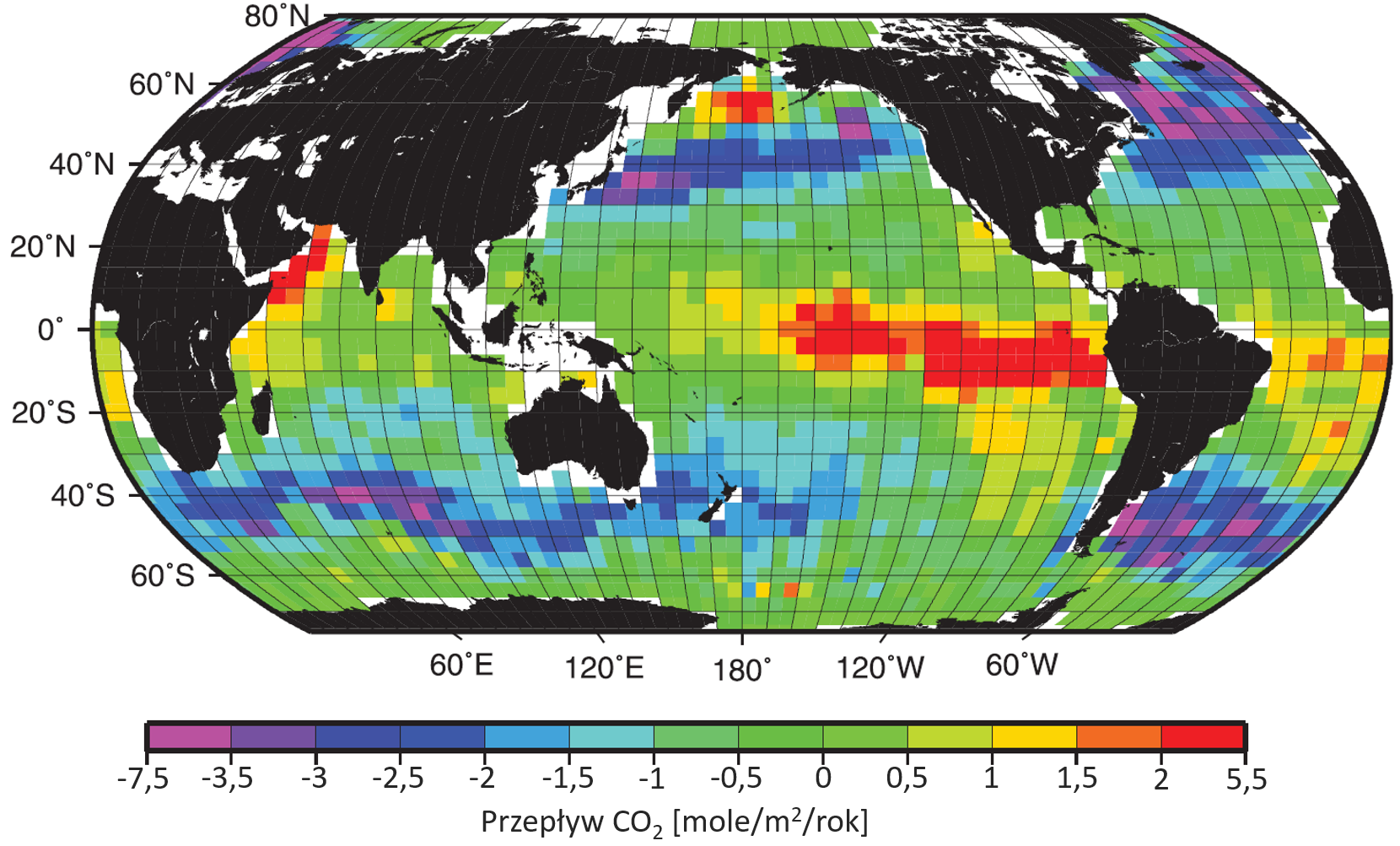
Strumień dwutlenku węgla pomiędzy atmosferą a oceanem jest tym większy, im większa jest różnica ciśnień cząstkowych CO2 w powietrzu i w wodzie. Aby obliczyć jego wartość, należy pomnożyć tę różnicę przez współczynnik związany z wielkością turbulencji wody morskiej, zwykle przedstawiany jako funkcja prędkości wiatru (im silniej wieje, tym mocniej miesza wodę).
Ponieważ rozpuszczalność CO2 w wodzie spada wraz ze wzrostem temperatury, równowaga ciśnień cząstkowych w ciepłych wodach występuje przy mniejszym stężeniu CO2 niż w chłodnych. Gdyby nie cyrkulacja oceaniczna i inne procesy, osiągnięty zostałby stan, w którym wody w rejonach polarnych byłyby nasycone CO2 mocniej niż w tropikach, a jednocześnie przepływy CO2 z wód oceanów do atmosfery i z powrotem bilansowałyby się lokalnie. Jak jednak widzimy na Rysunku 9, sytuacja jest bardziej złożona i pewne obszary oceanu pochłaniają CO2, a inne go emitują.
Zacznijmy od wody na Północnym Atlantyku, która płynąc na północ, wychładza się, przez co rozpuszcza się w niej coraz więcej CO2 (niebiesko-fioletowy rejon intensywnego pochłaniania CO2). W okolicach Grenlandii nasycona CO2 woda opada w głębiny i zaczyna trwającą 1000–1500 lat podróż. Wody głębinowe wybijają na powierzchnię w rejonach równikowych oraz w strefach wynoszenia (upwellingu) u wybrzeży kontynentów (np. zachodniej części Ameryki Północnej i Południowej) i ulegają ogrzaniu, uwalniając przy tym CO2. Miejsca wypływania wód głębinowych na powierzchnię widzimy na Rysunku 9 jako czerwone regiony emisji CO2.

Pompa biologiczna – w krążeniu węgla w oceanie uczestniczą też organizmy żywe
Proces ten jest wzmacniany przez kolejny mechanizm, powodujący dodatkowe zakwaszanie się wód głębinowych. Unoszący się w wodach przypowierzchniowych fotosyntetyzujący plankton pochłania CO2 i zamienia go w związki organiczne. Organizmy morskie w powierzchniowych warstwach oceanu wbudowują zredukowany węgiel w tkanki. Większość pochłoniętego w ten sposób węgla jest w procesach oddychania zwracana do otoczenia (zupełnie jak na lądzie), jednak część – około 20% – wraz z resztkami organicznymi (czy to martwych organizmów, czy odchodów) opada w głębiny oceaniczne. W ten sposób węgiel jest usuwany z powierzchniowych warstw oceanu w głębiny. Ten trafiający tam strumień opadającej z góry materii organicznej stanowi pożywienie zwierząt żyjących na większych głębokościach – od bakterii po duże organizmy. Oddychając, spalają one pochodzącą z wód przypowierzchniowych materię organiczną i wyzwalają w głębinach dwutlenek węgla, powodując zakwaszanie wody. Proces ten jest najintensywniejszy do głębokości ok. 1000 metrów, na większych głębokościach jest już na tyle słaby, że kompensuje go rozpuszczanie głębinowych osadów węglanu wapnia. Jeśli strumień szczątków opadających z powierzchni jest dostatecznie duży (i są to większe i/lub szybciej opadające na dno resztki), to pewna ilość materii organicznej zostaje zagrzebana w osadach bez rozkładu, usuwając w ten sposób węgiel z szybkiego cyklu węglowego. Mechanizm ten nazywa się pompą biologiczną.
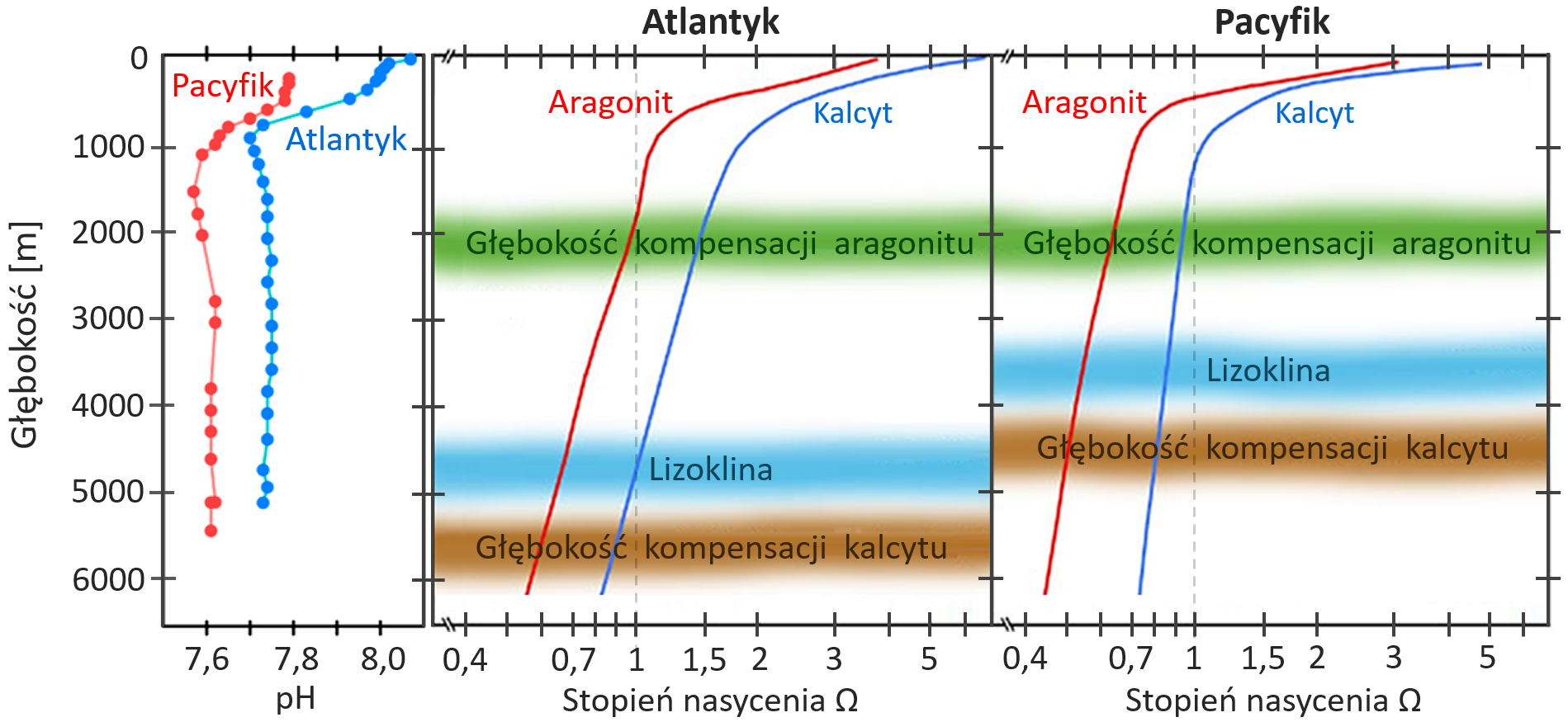
Współczynnik pH wód głębokiego tropikalnego Atlantyku wynosi ok. 7,7, a Pacyfiku ok. 7,6 (Rysunek 11. po lewej). Skąd ta różnica? To wynik działania pompy biologicznej, która „dorzuca” na taśmociąg głębinowej cyrkulacji oceanicznej materię organiczną (oraz minerały), tak że pod koniec transferu na Pacyfiku zbiera się ich tam więcej niż na początku jego biegu na Północnym Atlantyku.
Źródło Madl, 2005.
Co się dzieje w najgłębszych głębinach?
Przyjrzyjmy się teraz temu, co się dzieje w głębinach z węglanem wapnia. O ile wody przypowierzchniowe są nim przesycone, o tyle głębiej stopień nasycenia maleje. Dlaczego? Poznaliśmy już proces zakwaszania wód oceanicznych do głębokości 1000 metrów, któremu towarzyszy też spadek nasycenia wody jonami węglanowymi. Głębiej decydujące znaczenie ma wzrost rozpuszczalności węglanu wapnia wraz ze wzrostem głębokości. Rozpuszczalność węglanu wapnia rośnie wraz ze wzrostem ciśnienia (jest tak, ponieważ pod wysokim ciśnieniem preferowany jest stan o mniejszej objętości, a łączna objętość Ca2+ i CO32- jest mniejsza od objętości stałego CaCO3) oraz spadkiem temperatury (to zjawisko odwrotne niż w przypadku większości soli, związane z uwalnianiem energii termicznej towarzyszącej dysocjacji CaCO3). W rezultacie opadające w głębiny oceaniczne muszelki i szkieleciki po prostu rozpuszczają się po drodze, nie dostarczając tym samym węglanu wapnia na duże głębokości – zatem po prostu go tam nie ma (a unoszące się w wodzie nieliczne jony nie zostają w głębinach), więc nasycenie kalcytem i aragonitem spada poniżej Ω = 1.
Głębokość, poniżej której ΩKal spada poniżej 1, nazywamy głębokością kompensacji węglanu wapnia (ang. calcite compensation depth, CCD). Poniżej tej głębokości węglany się nie odkładają, a opadające z warstw przypowierzchniowych muszelki i szkieleciki się rozpuszczają. Często jest tu stosowana analogia wysokości zalegania śniegu na szczytach górskich, który powyżej niej może się odkładać, poniżej zaś topnieje. Jeśli dno oceanu znajduje się powyżej linii CCD, odkładają się na nim białe osady węglanu wapnia, jeśli zaś leży poniżej niej, będziemy na nim widzieć brązowe gliny i iły.
Na Rysunku 5. widzimy, że dla kalcytu Ω = 1 występuje na głębokości ok. 4000 na Pacyfiku i 5000 m na Atlantyku, a dla łatwiej rozpuszczającego się aragonitu występuje odpowiednio na 1000 m i 2500 m. Głębokość CCD zależy od nasycenia wód powierzchniowych dwutlenkiem węgla i intensywności jego transportu w głębiny (największej w miejscach tonięcia wód powierzchniowych), temperatury wód (zarówno ze względu na wyższe nasycenie CO2, jak i wyższą rozpuszczalność CaCO3) oraz produktywności biologicznej (skutkującej silną pompą biologiczną zasilającą głębiny w węgiel organiczny). Z tego powodu najmniejsza głębokość CCD jest w wodach biegunowych: 150–200 metrów dla kalcytu i nie więcej niż 100 metrów dla aragonitu. Stosunkowo niewielki wzrost kwasowości tych wód może więc spowodować, że organizmy budujące wapienne szkieleciki nie będą mogły w nich funkcjonować.
W efekcie opisanych wyżej procesów ilość węgla organicznego w ulegającej mieszaniu warstwie wody szacuje się na 150 GtC, a ilość osadów CaCO3 w wodach głębinowych (dostępnych do neutralizacji emisji CO2) na 1600 GtC. Powstają one dzięki niewielkiemu strumieniowi materii organicznej (~0,2 GtC/rok) docierającemu do dna oceanicznego.
O pochłanianiu dwutlenku węgla przez oceany i zaburzeniach tego procesu przeczytasz też w tekstach Oceany będą pochłaniały coraz mniej dwutlenku węgla, a o znaczeniu tych zjawisk dla życia morskiego w artykule Globalne ocieplenie, prądy morskie i życie w oceanach.
Artykuł jest przeredagowanym na potrzeby publikacji w internecie fragmentem książki Marcina Popkiewicza, Aleksandry Kardaś i Szymona Malinowskiego pt. Nauka o klimacie.
Więcej o cyklu węglowym: Szybki cykl węglowy, część 1: atmosfera i ekosystemy lądowe
Fajnie, że tu jesteś. Mamy nadzieję, że nasz artykuł pomógł Ci poszerzyć lub ugruntować wiedzę.
Nie wiem, czy wiesz, ale naukaoklimacie.pl to projekt non-profit. Tworzymy go my, czyli ludzie, którzy chcą dzielić się wiedzą i pomagać w zrozumieniu zmian klimatu. Taki projekt to dla nas duża radość i satysfakcja. Ale też regularne koszty. Jeśli chcesz pomóc w utrzymaniu i rozwoju strony, przekaż nam darowiznę w dowolnej wysokości







